- نحوه ی دسترسی به پایان نامه های دانشگاه های مختلف جهان
- کاغذ لیتموس برای شناسایی غذاهای فاسد
- وجود سلنیم در خون مادر از ورود سم به بدن جنین جلوگیری میکند
- تعادل شیمیایی-شیمی تجزیه
- اثزدما بر تعادل-شیمی تجزیه رشته صنایع شیمیایی
- اثر دما بر انحلال پذیری-شیمی تجزیه رشته صنایع شیمیایی
- آدرس فیسبوک سایت
- چگونه برف درست کنيم
- دودزا
- نارنجک با پرمنگنات پتاسيم
آخرین مطالب
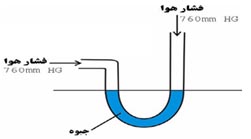
یک جسم مایع ، در یک دمای مشخص و معین تغییر حالت پیدا کرده و تبخیر میشود. این دمای معین ، همان نقطه ی جوش جسم مایع است . تغییر حالت از مایع به بخار زمانی انجام میگیرد که فشار بخار مایع با فشار محیط برابر شود .
زمانی که فشار محیط بنا به هر دلیلی کاهش پیدا کند ، فشار بخار ماده سریعتر با فشار محیط برابر میشود ، یعنی زودتر به جوش می آید ، نهایتا نقطه ی جوش نیز پائین می آید . این تغییرات دمایی نسبت به تغییرات فشار توسط فردی بنام کلاپیرون بررسی شده است .
رابطه نقطه جوش با فشار بخار ( آزمایش رامسی - یانگ )
یک جسم مایع ، در یک دمای مشخص و معین تغییر حالت پیدا کرده و تبخیر میشود. این دمای معین ، همان نقطه ی جوش جسم مایع است . تغییر حالت از مایع به بخار زمانی انجام میگیرد که فشار بخار مایع با فشار محیط برابر شود .
زمانی که فشار محیط بنا به هر دلیلی کاهش پیدا کند ، فشار بخار ماده سریعتر با فشار محیط برابر میشود ، یعنی زودتر به جوش می آید ، نهایتا نقطه ی جوش نیز پائین می آید . این تغییرات دمایی نسبت به تغییرات فشار توسط فردی بنام کلاپیرون بررسی شده است .
مزر مایع – بخار
برای یک ماده ف آنتروپی تبخیر در دمای T برابر H/T∆ است . بنابراین رابطه ی کلاپیرون برای مرز مایع – بخار عبارتند از :
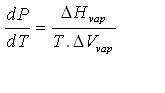
Hvap∆ مثبت است ، Vvap∆ بزرگ و مثبت است لذا dP/dTمثبت ولی بسیار کوچکتر از مقدار آن برای مزر جامد – مایع است . چون dT/dP بزرگ است ، از اینرو دمای جوش بسیار حساستر از دمای انجماد به فشار است .
از آنجا که حجم مولی گاز بسیار بزرگتر از حجم مولی مایع است بنابراین میتوان چنین نوشت :
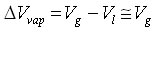
اگر گاز ( بخار ماده مورد نظر ) رفتار کامل داشته باشد میتوان رابطه ی کلاپیرون را چنین بازآرایی کرد :
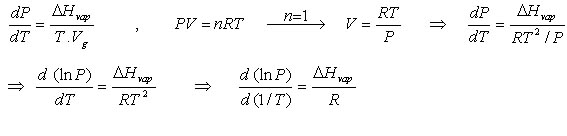
معادله ی فوق به معادله ی کلازیوس – کلاپیرون معروف است . این معادله امکان پیش بینی تغییرات فشار بخار با دما را به ما می دهد و نشان می دهد که چگونه دمای جوش با تغییر فشار تغییر می کند .
اگر آنتالپی تبخیر را مستقل از دما فرض کنیم ، می توانیم انتگرال فوق را به ترتیب زیر حل کنیم :
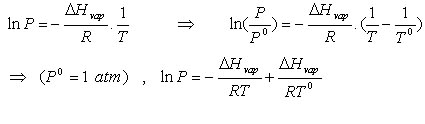
باید به این نکته توجه کرد که رابطه ی بدست آمده در محدوده ی دمایی و محدوده ی فشار معینی قابل استفاده است و در نقطه ی بحرانی و بالاتر از آن صدق نمیکند . به کمک این رابطه میتوان ، فشار بخار مایع را در نزدیکی دمای جوش معمولی آن به تقریب پیدا کرد . یعنی برای محاسبه Hvap∆ باید فشار هایی را اعمال کرد که نقاط جوش نزدیک به مقدار معمول بدست آید .
اگر تغییرات دما و فشار زیاد باشد نمیتوان از این رابطه استفاده کرد ، چون مقدار Hvap∆ نسبت به تغییر دما ، تغییر خواهد کرد.
در روش رامسی – یانگ ، مقدار اندکی از مایع برای اجرای آزمایش کافی است و در فشار های مختلف که مانومتر آنرا نشان می دهد ، میتوان نقطه ی جوش را از روی ترمومتر قرائت کرد .
مانومتر دستگاه فشارسنج برای اندازه گیری فشار گازها است.
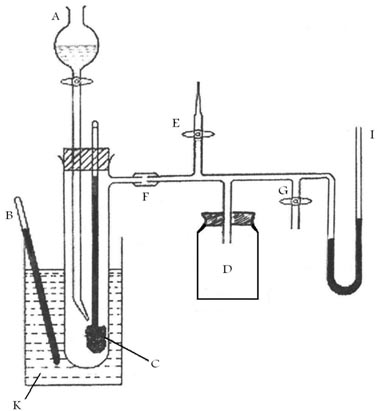
دستگاه رامسی – یانگ
این دستگاه از قسمت ها و بخش های مختلف تشکیل شده است که هر کدام نفش خاصی را در این آزمایش ایفا می کنند . این قسمت ها عبارتند از :
A= لوله متصل به قیف چکاننده که مایع مورد نظر در آن ریخته میشود
B = ترمومتر که در داخل حمام قرار دارد
C = ترمومتر که با پنبه یا پشم شیشه پوشیده شده
D = ظرف پایدار کننده فشار
E = دریچه ورود هوا جهت افزایش فشار سیستم
F = تله که درداخل بشرحاوی یخ و نمک قراردارد وجهت جمع آوری بخارات بکار میرود
G = پمپ خلا
I = مانومتر
K = حمام آب گرم
شرح آزمایش :
مایع مورد نظر را در محفظه ی قیف چکاننده ریخته و خلا را تا جایی اعمال می کنیم که فشار درون سیستم حدود cmHg 20 شود . شیر قیف را به آرامی باز کرده و آنرا طوری تنظیم می کنیم که تقریبا در هر 6 ثانیه یک قطره بچکد . جریان مایع باید طوری تنظیم شود که هر قطره ی ریخته شده قبل از ریختن قطره ی قبلی روی پنبه تبخیر شود.
مایع روی پنبه در اثر تراکم بخار گرم میشود و به دنبال تبخیر آن محیط سرد میشود تا جایی که تعادلی بین مایع و بخار برقرار شود . این دما ، دمای ثابتی است که باید آنرا یادداشت کنیم . این دما همان نقطه ی جوش جسم در فشار 20 cmHg می باشد . دریچه E باز می کنیم تا کمی هوا وارد سیستم شده و فشار آن تا حدود 30 cmHg افزایش یابد . دمای جوش را نیز در این فشار تعیین می کنیم . این عمل را برای فشار های 40،50،60 cmHg تکرار کرده و نقطه ی جوش را با استفاده از روابط و رسم نمودار بدست آورید.
سایت رشته صنایع شیمیایی...مزر مایع – بخار
برای یک ماده ف آنتروپی تبخیر در دمای T برابر H/T∆ است . بنابراین رابطه ی کلاپیرون برای مرز مایع – بخار عبارتند از :
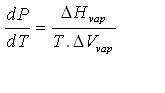
Hvap∆ مثبت است ، Vvap∆ بزرگ و مثبت است لذا dP/dTمثبت ولی بسیار کوچکتر از مقدار آن برای مزر جامد – مایع است . چون dT/dP بزرگ است ، از اینرو دمای جوش بسیار حساستر از دمای انجماد به فشار است .
از آنجا که حجم مولی گاز بسیار بزرگتر از حجم مولی مایع است بنابراین میتوان چنین نوشت :
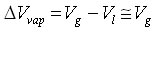
اگر گاز ( بخار ماده مورد نظر ) رفتار کامل داشته باشد میتوان رابطه ی کلاپیرون را چنین بازآرایی کرد :
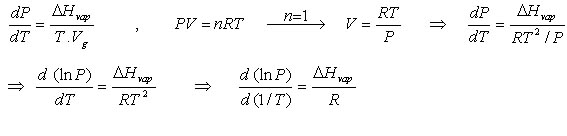
معادله ی فوق به معادله ی کلازیوس – کلاپیرون معروف است . این معادله امکان پیش بینی تغییرات فشار بخار با دما را به ما می دهد و نشان می دهد که چگونه دمای جوش با تغییر فشار تغییر می کند .
اگر آنتالپی تبخیر را مستقل از دما فرض کنیم ، می توانیم انتگرال فوق را به ترتیب زیر حل کنیم :
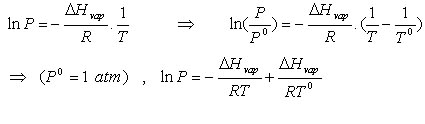
باید به این نکته توجه کرد که رابطه ی بدست آمده در محدوده ی دمایی و محدوده ی فشار معینی قابل استفاده است و در نقطه ی بحرانی و بالاتر از آن صدق نمیکند . به کمک این رابطه میتوان ، فشار بخار مایع را در نزدیکی دمای جوش معمولی آن به تقریب پیدا کرد . یعنی برای محاسبه Hvap∆ باید فشار هایی را اعمال کرد که نقاط جوش نزدیک به مقدار معمول بدست آید .
اگر تغییرات دما و فشار زیاد باشد نمیتوان از این رابطه استفاده کرد ، چون مقدار Hvap∆ نسبت به تغییر دما ، تغییر خواهد کرد.
در روش رامسی – یانگ ، مقدار اندکی از مایع برای اجرای آزمایش کافی است و در فشار های مختلف که مانومتر آنرا نشان می دهد ، میتوان نقطه ی جوش را از روی ترمومتر قرائت کرد .
مانومتر دستگاه فشارسنج برای اندازه گیری فشار گازها است.

دستگاه رامسی – یانگ
این دستگاه از قسمت ها و بخش های مختلف تشکیل شده است که هر کدام نفش خاصی را در این آزمایش ایفا می کنند . این قسمت ها عبارتند از :
A= لوله متصل به قیف چکاننده که مایع مورد نظر در آن ریخته میشود
B = ترمومتر که در داخل حمام قرار دارد
C = ترمومتر که با پنبه یا پشم شیشه پوشیده شده
D = ظرف پایدار کننده فشار
E = دریچه ورود هوا جهت افزایش فشار سیستم
F = تله که درداخل بشرحاوی یخ و نمک قراردارد وجهت جمع آوری بخارات بکار میرود
G = پمپ خلا
I = مانومتر
K = حمام آب گرم

شرح آزمایش :
مایع مورد نظر را در محفظه ی قیف چکاننده ریخته و خلا را تا جایی اعمال می کنیم که فشار درون سیستم حدود cmHg 20 شود . شیر قیف را به آرامی باز کرده و آنرا طوری تنظیم می کنیم که تقریبا در هر 6 ثانیه یک قطره بچکد . جریان مایع باید طوری تنظیم شود که هر قطره ی ریخته شده قبل از ریختن قطره ی قبلی روی پنبه تبخیر شود.
مایع روی پنبه در اثر تراکم بخار گرم میشود و به دنبال تبخیر آن محیط سرد میشود تا جایی که تعادلی بین مایع و بخار برقرار شود . این دما ، دمای ثابتی است که باید آنرا یادداشت کنیم . این دما همان نقطه ی جوش جسم در فشار 20 cmHg می باشد . دریچه E باز می کنیم تا کمی هوا وارد سیستم شده و فشار آن تا حدود 30 cmHg افزایش یابد . دمای جوش را نیز در این فشار تعیین می کنیم . این عمل را برای فشار های 40،50،60 cmHg تکرار کرده و نقطه ی جوش را با استفاده از روابط و رسم نمودار بدست آورید.
ما را در سایت سایت رشته صنایع شیمیایی دنبال می کنید
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 1614
آرشیو مطالب
- اسفند 1386
- مهر 1386
- آبان 1386
- دی 1387
- بهمن 1387
- اسفند 1387
- فروردين 1387
- خرداد 1387
- مهر 1387
- آبان 1387
- آذر 1387
- بهمن 1388
- اسفند 1388
- فروردين 1388
- ارديبهشت 1388
- خرداد 1388
- تير 1388
- شهريور 1388
- آبان 1388
- بهمن 1389
- اسفند 1389
- فروردين 1389
- ارديبهشت 1389
- خرداد 1389
- تير 1389
- شهريور 1389
- مهر 1389
- آبان 1389
- دی 1390
- بهمن 1390
- اسفند 1390
- فروردين 1390
- ارديبهشت 1390
- خرداد 1390
- مرداد 1390
- شهريور 1390
- مهر 1390
- آبان 1390
- آذر 1390
- دی 1391
- بهمن 1391
- اسفند 1391
- فروردين 1391
- ارديبهشت 1391
- تير 1391
- مرداد 1391
- شهريور 1391
- مهر 1391
- آبان 1391
- آذر 1391
- بهمن 1392
- اسفند 1392
- فروردين 1392
- تير 1392
- مرداد 1392
- شهريور 1392
- آبان 1392
لینک دوستان
- کرم سفید کننده وا
- دانلود آهنگ جدید
- خرید گوشی
- فرش کاشان
- بازار اجتماعی رایج
- خرید لایسنس نود 32
- هاست ایمیل
- خرید بانه
- خرید بک لینک
- کلاه کاسکت
- موزیک باران
- دانلود آهنگ جدید
- ازن ژنراتور
- نمایندگی شیائومی مشهد
- مشاوره حقوقی تلفنی با وکیل
- کرم سفید کننده واژن
- اگهی استخدام کارپ
- دانلود فیلم
- آرشیو مطالب
- فرش مسجد
- دعا
- لیزر موهای زائد
- رنگ مو
- شارژ
نظر سنجی
سایت صنایع شیمیایی...

