- نحوه ی دسترسی به پایان نامه های دانشگاه های مختلف جهان
- کاغذ لیتموس برای شناسایی غذاهای فاسد
- وجود سلنیم در خون مادر از ورود سم به بدن جنین جلوگیری میکند
- تعادل شیمیایی-شیمی تجزیه
- اثزدما بر تعادل-شیمی تجزیه رشته صنایع شیمیایی
- اثر دما بر انحلال پذیری-شیمی تجزیه رشته صنایع شیمیایی
- آدرس فیسبوک سایت
- چگونه برف درست کنيم
- دودزا
- نارنجک با پرمنگنات پتاسيم
آخرین مطالب
هدف : بدست آوردن یا تخمین زدن صفر مطلق به روش برون یابی .
ابزار و مواد لازم:
بالن، درپوش، لوله و گیره، حمام آب سرد، استوانه مدرج، دما سنج، تشت پلاستیکی و آب
تئوری آزمایش :
مقدمه :
ما در این آزمایش علاوه بر بررسی رابطۀ بین حجم گاز و درجه حرارت اطلاعات کافی برای صفر مطلق ( صفر درجه کلوین ) از طریق روش برون یابی بدست می آوریم . برون یابی روشی است که از طریق رسم منحنی می توان یک مقدار عددی که خارج از محدودۀ آزمایش می باشد را تعیین کرد. نقطه مرجع در مقیاس دمای مطلق (273,15-) سانتیگراد است. این نقطه را صفر مطلق میگویند، معنای آن تنها پس ار روشن شدن ارتباط منشا گاز با انرژی جنبشی اتمهای آن با توجه به نظریه جنبشی گازها روشن شد. این نظریه بیان میکند که حرکت اتمها در صفر مطلق به کلی متوقف میشود، ولی این توضیح درست نیست در واقع مکانیک کلاسیک قادر به توضیح این پدیده نیست، ولی مکانیک کوانتومی آن را به خوبی توضیح میدهد.
هدف : بدست آوردن یا تخمین زدن صفر مطلق به روش برون یابی .
ابزار و مواد لازم:
بالن، درپوش، لوله و گیره، حمام آب سرد، استوانه مدرج، دما سنج، تشت پلاستیکی و آب
تئوری آزمایش :
مقدمه :
ما در این آزمایش علاوه بر بررسی رابطۀ بین حجم گاز و درجه حرارت اطلاعات کافی برای صفر مطلق ( صفر درجه کلوین ) از طریق روش برون یابی بدست می آوریم . برون یابی روشی است که از طریق رسم منحنی می توان یک مقدار عددی که خارج از محدودۀ آزمایش می باشد را تعیین کرد. نقطه مرجع در مقیاس دمای مطلق (273,15-) سانتیگراد است. این نقطه را صفر مطلق میگویند، معنای آن تنها پس ار روشن شدن ارتباط منشا گاز با انرژی جنبشی اتمهای آن با توجه به نظریه جنبشی گازها روشن شد. این نظریه بیان میکند که حرکت اتمها در صفر مطلق به کلی متوقف میشود، ولی این توضیح درست نیست در واقع مکانیک کلاسیک قادر به توضیح این پدیده نیست، ولی مکانیک کوانتومی آن را به خوبی توضیح میدهد.
نظریه جنبشی گازها :
نظریه جنبشی گازها ، الگویی برای تبیین نظم و ترتیب مشاهده شده در رفتار تمام گازها به دست می دهد . در 1738 میلادی ، دانیل برنولی قانون بویل را با این فرض که فشار گاز نتیجه برخورد مولکول های گاز با دیواره ی ظرف است ، تبیین کرد . توضیح برنولی ، اولین و ساده ترین تفسیر جنبه های کلیدی نظریه جنبشی است .
این نظریه در اواسط سدۀ نوزدهم توسط بسیاری از دانشمندان، به ویژه کرونیگ ، کلازیوس ، ماکسول و بولتزمان مورد توجه قرار گرفت و گسترش داده شد .
نظریه جنبشی گازها ، شامل پدیده های زیر است :
• گاز ها از مولکول هایی که در فضا کاملا از همدیگر جدا هستند ، تشکیل یافته اند . حجم واقعی هر یک از مولکولها در مقایسه با حجم کل گاز ، ناچیز است . واژۀ مولکول در این جا برای مشخص کردن کوچک ترین ذره هر گاز به کار می رود ; برخی از گاز ها ( مثلا گازهای نجیب ) شامل اتم های ترکیب نشده اند .
• مولکول های گاز در حرکت مستقیم الخط ، سریع ، و مداوم هستند ; با یکدیگر و با دیوارۀ ظرف برخورد می کنند . گرچه در این برخورد ها ممکن است انرژی از یک مولکول به مولکول دیگر منتقل شود ، ولی انرژی جنبشی ( انرژی حرکت ) از میان نمی رود .
• انرژی جنبشی میانگین مولکول های یک گاز به دما بستگی دارد ; با افزایش دما ، زیاد می شود . در یک دمای معیین ، مولکول های تمام گاز ها دارای انرژی جنبشی میانگین یکسان هستند .
• نیروی جاذبۀ بین مولکول های گاز ، ناچیز و قابل چشم پوشی است .
قوانین گاز ها را بر اساس نظریه جنبشی می توان تبیین کرد . قانون بویل را در نظر بگیرید . بر اساس نظریه جنبشی ، فشار گاز ناشی از برخورد های مولکولی با دیواره ظرف است . اگر تعداد مولکول ها در واحد حجم ( غلظت مولکولی ) افزایش یابد ، فشار نیز به علت افزایش تعداد برخورد ها در واحد زمان ، بالا خواهد رفت . کاهش حجم یک گاز باعث تجمع مولکول ها در فضای کوچک تری خواهد شد ; غلظت مولکولی افزایش خواهد یافت و فشار نیز متناسب با آن ، بالا خواهد رفت .
قانون شارل و قانون آمونتون ، خواص گاز ها را به تغییرات دما مربوط می سازد . انرژی جنبشی میانگین مولکول های ، به طور نظری ، صفر است ; مولکول ها بی حرکت اند . چون حجم مولکول های یک گاز ایده آل قابل صرف نظر کردن است ، حجم یک گاز ایده آل در دمای مطلق نیز ، به طور نظری ، صفر است .افزایش دما ، حرکت سریع مولکول ها را سبب می شود . برخورد مولکول های گاز با دیوارۀ ظرف ، شدید تر و بیشتر میشود . در نتیجه فشار به شیوه ای که قانون آمونتون پیش بینی می کند ، بالا می رود .
فشار گازی که گرما به آن داده می شود ، در صورتی ثابت می ماند که حجم آن افزایش یابد . افزایش حجم ، سبب کاهش تعداد برخورد های مولکول ها با دیواره ظرف در واحد زمان می شود و به این ترتیب فشار را ثابت نگه می دارد . به این ترتیب کاهش تعداد برخورد ها با افزایش شدت برخورد ها جبران می شود . قانون شارل بیانگر این وضعیت است.
صفر مطلق :
1- فیزیک در صفر مطلق
نظریه جنبشی گازها بیان میکند که در صفر مطلق حرکت اتمها به کلی متوقف میشود و دمای مطلق T تنها معیاری از اندازه انرژی جنبشی اتم هاست و بس. اما این توضیح هر چند ساده واضح است،درست نیست. اکثر دماها در فلزات حتی در دمای T = 0 نیز با سرعتهای بالا حرکت میکنند. مکانیک کوانتومی برای خیلی از مفاهیم توضیحات طبیعی دارد از جمله دمای مطلق و صفر مطلق.
2- مفهوم صفر مطلق در نظریه کوانتومی
مفهوم صفر مطلق در نظریه کوانتومی معنای روشن و قاطعی دارد، در میان ترازهای انرژی هر دستگاه کوانتومی ترازی وجود دارد که با پایینترین انرژی متناظر است و در مثال ما ، این حالت حالتی است که اسپین همه الکترونها در راستای مخالف میدان قرار میگیرند. در صفر مطلق ، دستگاه در حالت پایه است، از اینرو نمیتواند به دستگاه دیگری انرژی انتقال دهد، دقیقا بدین سبب که تراز پایینتری وجود ندارد که بعد از ، از دست دادن انرژی به آن انتقال یابد.
3- دست نیافتنی بودن صفر مطلق
هر کسی میداند که دمای جسم را نمیتوان تا صفر مطلق پایین آورد، هر چند میتوان به آن نزدیک شد. برای اینکه دمای جسمی را تا صفر مطلق پایین بیاوریم لازم است مقداری متناهی گرما از آن بگیریم. برای اینکار از چرخه کارنو استفاده میکنیم :
T1/T2 = φ1/φ2
بدیهی است که در این نظر در چرخه کارنو مقدار گرما یا دما مطرح نیست، بلکه نسبت آنها مهم است. اکنون دیگر مشکل نیست که بفهمیم چرا برای پایین آوردن دمای جسمی تا صفر مطلق باید تعداد بی شماری مراحل را پشت سر گذاشت. هر مرحله میتواند یک چرخه بسته یا یک فرآیند تک ، مثل انبساط بی دررو گاز در حال سرد شدن باشد. در هر مرحله مقداری متناهی کار انجام میگیرید و دما به نسبت متناهی پایین میآید. از آنجا که هر مرحله مدت زمانی طول میکشد، زمان لازم برای پایین آوردن دمای جسم تا صفر مطلق لزوما نامتناهی است.
صفر مطلق و نظریه جنبشی گازها :
میتوان پرسید که آیا دست نیافتنی بودن صفر مطلق در نظریه جنبشی گازها متفاوت است، آیا کسی میتواند اسپین همه الکترونها را به حالت پایه پایین بیاورد (به عنوان مثال ، آنقدر صبر کند که همه فزونی انرژیشان را تابش کنند. اما این سوال چیزی را روشن نمیکند. اگر دستگاه در یک فضای تهی نامتناهی بود و انرژیِ تابشی از آن برای همیشه دور میشود، اسپینها به یقین همه انرژیشان را از دست میدادند و دستگاه به حالتی متناظر با صفر مطلق میرسید. اما دستگاه در داخل حجمی باشد که دیوارههای آن در دمای ثابت نگه داشته میشود، آنگاه دستگاه دارای دمای دیوارهها میشود، در این صورت ممکن نیست بدون انجام دادن کار این دما را پایین تر آورد.
شرح آزمایش :
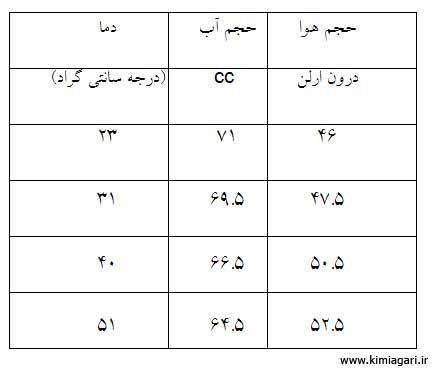
جهت بدست آوردن حجم واقعی ارلن، آن را از آب پر می کنیم سپس درپوش را بر روی ارلن قرار داده و لولۀ متصل به درپوش را به آرامی در ارلن فرو می کنیم تا میان درپوش و لوله حباب ایجاد نشود سپس جهت کاهش خطا میزان فرو رفتن لوله و در پوش را علامت می زنیم تا در طول آزمایش تغییر حجم نداشته باشیم . سپس حجم آب درون ارلن را خارج کرده و اندازه گیری می کنیم و به عنوان حجم اولیه ( V0 ) یادداشت می کنیم .
پس از اندازه گیری حجم واقعی ارلن ، ارلن را خشک کرده ( با استفاده از استون یا حرارت دادن به ارلن ) و سپس درپوش و لولۀ متصل به درپوش را در جای علامت گذاری شده قرار داده و به کمک گیره آن را درون حمام آب گرم (آب جوش با دمای 100درجه سانتی گراد ) قرار می دهیم و به ارلن زمان می دهیم تا هوای درون ارلن با محیط اطراف ( حمام آب گرم ) یکی شود . سپس با انگشت راه لوله را مصدود کرده و از حمام آب گرم خارج کرده و به صورت برعکس در حمام آب سرد قرار می دهیم و با برداشتن انگشت راه لوله را باز می کنیم و سپس به ارلن زمان می دهیم تا هوای درون ارلن با محیط اطراف ( حمام آب سرد ) یکی شود . پس از به تعادل رسیدن دمای هوای درون ارلن با حمام دوباره به کمک انگشت راه لوله را مصدود می کنیم و ارلن را از حمام خارج می کنیم و حجم آب وارد شده به ارلن را اندازه گیری می کنیم و به عنوان حجم ثانویه ( V1 ) یادداشت می کنیم . این آزمایش را چند مرتبه دیگر با تغییر دمای حمام آب سرد ادامه می دهیم .
نمونه محاسبات:
به کمک حجم اولیه ( V0 ) :
حجم اولیه → 117
و با استفاده از تفریق حجم اولیه (V0 ) با حجم ثانویه ( V ) :
فضای خالی V0 – V = V →
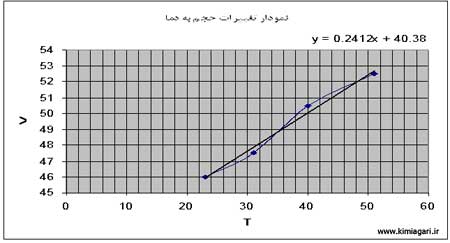
و با قرار دادن اعداد به دست آمده در محور y ها و قرار دادن دماهای مربوط به اعداد به دست آمده در محور x ها ، نمودار مربوطه را رسم نموده و معادله خط مربوطه را بدست می آوریم .
Y = 0/2412 X + 40/38
در نتیجه با بدست آوردن X از راه معادله :
Y = aX + b → Y = 0 → X = -b/a
در نتیجه معادلۀ بالا مقدار X ( صفر مطلق ) برابر است با : 41/167-
جدول اطلاعات و نمودار :
نتیجه گیری:
از این آزمایش می توان نتیجه گرفت که نظریه جنبشی گازها بیان میکند که در صفر مطلق حرکت اتمها به کلی متوقف میشود و دمای مطلق T تنها معیاری از اندازه انرژی جنبشی اتم هاست و یکی از ساده ترین راه های تقریب زدن صفر مطلق استفاده از قانون گاز ایده آل است که در این آزمایش نیز از این راه استفاده شده است.
همچنین در دما و فشار ثابت ، حجم یک گاز با تعداد مول های آن نسبت مستقیم دارد . تعیین صفر مطلق به روش برون یابی بر اساس رابطۀ مستقیم بین درجه حرارت و حجم می باشد .
منابع خطا:
• ثابت نبودن فشار در آزمایش زیرا به علت پایین نرفتن کامل ارلن به درون آب حمام سرد و همچنین کوچک بودن ظرف حمام آب گرم که باعث می شود ارلن تا حد کافی درون حمام نرود باعث ایجاد خطای نامبرده می شود .
• وجود حباب در انتهای درپوش لاستیکی زیرا در هنگام اندازه گیری حجم اولیه ارلن به کمک آب ، در صورت قرار دادن همزمان درپوش و لوله بر روی ارلن در انتهای درپوش و کنار لوله حباب هایی تشکیل می شود .
• متعادل نشدن دمای حمام آب گرم و سرد با حجم هوای درون ارلن.
منابع و ماخذ:
www.kimiagari.ir
این متن ناقص است برای مشاهده متن کامل آن را دانلود نمایید.
در صورت خراب بودن لینک دانلود " در قسمت نظر دهید " به ما اطلاع دهید تا مشکل را رفع کنیم
حجم فایل : 50 کیلو بایت | فرمت فایل : Docx | زبان : فارسی
دانلود مستقیم | پسورد فایل : kimiagari.ir

گزارش کار تعیین گرمای واکنش سود جامد درآب - دوشنبه نهم مرداد 1391
گزارش کار اندازه گیری دانسیته هوا - یکشنبه هشتم مرداد 1391
گزارش کار بمب کالریمتر جهت تعیین آنتالپی - یکشنبه هشتم مرداد 1391
گزارش کار تعیین مرتبه و ثابت سرعت واکنش - یکشنبه هشتم مرداد 1391
گزارش کار تعیین ضریب انبساط حجمی مایعات - یکشنبه هشتم مرداد 1391
گزارش کار تعیین سختی کل آب - شنبه هفتم مرداد 1391
گزارش کار دبي سنجی سيالات - جمعه ششم مرداد 1391
گزارش کار اندازه گیری دبی با استفاده از اختلاف فشار - جمعه ششم مرداد 1391
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 229
آرشیو مطالب
- اسفند 1386
- مهر 1386
- آبان 1386
- دی 1387
- بهمن 1387
- اسفند 1387
- فروردين 1387
- خرداد 1387
- مهر 1387
- آبان 1387
- آذر 1387
- بهمن 1388
- اسفند 1388
- فروردين 1388
- ارديبهشت 1388
- خرداد 1388
- تير 1388
- شهريور 1388
- آبان 1388
- بهمن 1389
- اسفند 1389
- فروردين 1389
- ارديبهشت 1389
- خرداد 1389
- تير 1389
- شهريور 1389
- مهر 1389
- آبان 1389
- دی 1390
- بهمن 1390
- اسفند 1390
- فروردين 1390
- ارديبهشت 1390
- خرداد 1390
- مرداد 1390
- شهريور 1390
- مهر 1390
- آبان 1390
- آذر 1390
- دی 1391
- بهمن 1391
- اسفند 1391
- فروردين 1391
- ارديبهشت 1391
- تير 1391
- مرداد 1391
- شهريور 1391
- مهر 1391
- آبان 1391
- آذر 1391
- بهمن 1392
- اسفند 1392
- فروردين 1392
- تير 1392
- مرداد 1392
- شهريور 1392
- آبان 1392
لینک دوستان
- کرم سفید کننده وا
- دانلود آهنگ جدید
- خرید گوشی
- فرش کاشان
- بازار اجتماعی رایج
- خرید لایسنس نود 32
- هاست ایمیل
- خرید بانه
- خرید بک لینک
- کلاه کاسکت
- موزیک باران
- دانلود آهنگ جدید
- ازن ژنراتور
- نمایندگی شیائومی مشهد
- مشاوره حقوقی تلفنی با وکیل
- کرم سفید کننده واژن
- اگهی استخدام کارپ
- دانلود فیلم
- آرشیو مطالب
- فرش مسجد
- دعا
- لیزر موهای زائد
- رنگ مو
- شارژ

