- نحوه ی دسترسی به پایان نامه های دانشگاه های مختلف جهان
- کاغذ لیتموس برای شناسایی غذاهای فاسد
- وجود سلنیم در خون مادر از ورود سم به بدن جنین جلوگیری میکند
- تعادل شیمیایی-شیمی تجزیه
- اثزدما بر تعادل-شیمی تجزیه رشته صنایع شیمیایی
- اثر دما بر انحلال پذیری-شیمی تجزیه رشته صنایع شیمیایی
- آدرس فیسبوک سایت
- چگونه برف درست کنيم
- دودزا
- نارنجک با پرمنگنات پتاسيم
آخرین مطالب
هدف: تعیین گرمای واکنش سود جامد درآب
ابزار و مواد لازم:
ارلن مایر، استوانه مدرج، همزن، دماسنج، ترازو، سود جامد، اسید کلریدریک
تئوری آزمایش :
مفهوم ظرفیت گرمایی :
"ژول" با آزمایش نشان داد که هرگاه مقدار معینی از انرژی مکانیکی به گرما تبدیل شود، مقدار گرمای حاصل همیشه یکسان است. بنابراین همارزی گرما و کار مکانیکی بهعنوان دو شکل انرژی کاملا محرز است. " هلمهولتز " اولین کسی بود که بوضوح بیان کرد که نهتنها گرما و انرژی مکانیکی ، بلکه تمام شکلهای انرژی همارزند و مقدار معینی از یک شکل انرژی از بین نمیرود، مگر آنکه همان مقدار در یکی از شکلهای دیگر انرژی ظاهر شود، بنابراین گرما صورتی از انرژی است.
حال اگر چنانچه بخواهیم دمای جسمی را به اندازه واحد افزایش دهیم، در این صورت بسته به نوع جسم ، این مقدار گرما متفاوت خواهد بود. کلمه ظرفیت، در ظرفیت گرمایی بویژه گمراه کننده است، چون عبارت مقدار گرمایی را که یک جسم میتواند نگه دارد، به یاد میآورد که اساسا بیمعنا است.اصولا میتوان ظرفیت گرمایی را بهعنوان یک ثابت تناسب در نظرگرفت، یعنی مقدار گرمای داده شده به یک جسم با تغییر دمای آن جسم متناسب است و با ضرب کردن ظرفیت گرمایی در طرف دوم این رابطه ، رابطه تناسبی به یک تساوی تبدیل میشود، یعنی نسبت مقدار انرژی گرمایی که به یک جسم داده میشود، بر افزایش دمای متناظر با آن را ظرفیت گرمایی آن جسم میگویند به عبارت دیگر نسبت گرمای مبادله شده با سیستم به تغییر دمای ناشی از مبادله گرما را ظرفیت گرمایی می گویند.
هدف: تعیین گرمای واکنش سود جامد درآب
ابزار و مواد لازم:
ارلن مایر، استوانه مدرج، همزن، دماسنج، ترازو، سود جامد، اسید کلریدریک
تئوری آزمایش :
مفهوم ظرفیت گرمایی :
"ژول" با آزمایش نشان داد که هرگاه مقدار معینی از انرژی مکانیکی به گرما تبدیل شود، مقدار گرمای حاصل همیشه یکسان است. بنابراین همارزی گرما و کار مکانیکی بهعنوان دو شکل انرژی کاملا محرز است. " هلمهولتز " اولین کسی بود که بوضوح بیان کرد که نهتنها گرما و انرژی مکانیکی ، بلکه تمام شکلهای انرژی همارزند و مقدار معینی از یک شکل انرژی از بین نمیرود، مگر آنکه همان مقدار در یکی از شکلهای دیگر انرژی ظاهر شود، بنابراین گرما صورتی از انرژی است.
حال اگر چنانچه بخواهیم دمای جسمی را به اندازه واحد افزایش دهیم، در این صورت بسته به نوع جسم ، این مقدار گرما متفاوت خواهد بود. کلمه ظرفیت، در ظرفیت گرمایی بویژه گمراه کننده است، چون عبارت مقدار گرمایی را که یک جسم میتواند نگه دارد، به یاد میآورد که اساسا بیمعنا است.اصولا میتوان ظرفیت گرمایی را بهعنوان یک ثابت تناسب در نظرگرفت، یعنی مقدار گرمای داده شده به یک جسم با تغییر دمای آن جسم متناسب است و با ضرب کردن ظرفیت گرمایی در طرف دوم این رابطه ، رابطه تناسبی به یک تساوی تبدیل میشود، یعنی نسبت مقدار انرژی گرمایی که به یک جسم داده میشود، بر افزایش دمای متناظر با آن را ظرفیت گرمایی آن جسم میگویند به عبارت دیگر نسبت گرمای مبادله شده با سیستم به تغییر دمای ناشی از مبادله گرما را ظرفیت گرمایی می گویند.
ظرفیت گرمایی واحد جرم یک جسم را ظرفیت گرمایی ویژه آن جسم و ظرفیت گرمایی به ازای یک مول از ماده را ظرفیت گرمایی مولی می گویند. گرما از طریق آثار آن بر جسمی که از آن عبور می کند بررسی می شود. می توان تصور کرد که هر جسم ظرفیتی برای گرما دارد. هر چه در یک جسم تغییر دما به علت انتقال مقدار مشخصی از گرما کم تر باشد، ظرفیت آن بیش تر است. مشکل این است که C را، مانند Q، به جای یک تابع حالت، یک کمیت وابسته به فرایند می کند. انرژی داخلی ماده با افزایش دما زیاد می شود. این افزایش به شرایطی بستگی دارد که گرما داده می شود. ظرفیت گرمایی در حجم ثابت را با CV نمایش می دهند و چنین تعریف می شود:
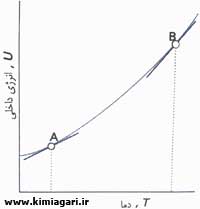
شکل 1 - با افزایش دما انرژی داخلی سیستم زیاد می شود. در این نمودار تغییرات آن در حجم ثابت نشان داده شده است. شیب نمودار در هر دمایی که به صورت خطوط مماس در A و B نشان داده شده اند ظرفیت گرمایی در حجم ثابت در آن دماست. توجه کنید که برای سیستم مورد نظر، ظرفیت گرمایی در B بزرگتر از مقدار آن در A است.
به بیان دیگر گرمای ویژه هر جسم عبارت است از مقدار گرمایی که باید به یک کیلو گرم از آن جسم داده شود تا دمای آن یک درجه سلسیوس افزایش یابد.
گرمای ویژه C = Q/m∆Ө Q = mC∆Ө
که Q گرمای واکنش، m جرم، C گرمای ویژه، ∆Ө اختلاف دما می باشد.
شرح آزمایش :
در این آزمایش می خواهیم با استفاده از رابطه فوق میزان گرمای واکنش را برای حالت های زیر مشخص کنیم:
1- تعیین گرمای واکنش سود جامد در آب.
2- تعیین گرمای واکنش سود جامد در محلول اسید کلریدریک.
3- تعیین گرمای خنثی شدن محلول سود در محلول اسید کلریدریک.
برای این منظور ابتدا قبل از مخلوط کردن مواد، دمای معمولی آب و نیز محلول اسید کلریدریک را با دماسنج اندازه می گیریم سپس وزن50 cc از هر کدام را توسط ترازو اندازه می گیریم و سپس دمای واکنش سود با آب و محلول اسید کلریدریک را به طور جداگانه و نیز دمای حاصل از واکنش محلول سود در محلول اسیدکلریدریک را اندازه گیری کرده و با استفاده از رابطه، گرمای حاصل از واکنش در هر حالت را بدست می آوریم.
Cشیشه = 0.2 cal/gr 0C Cمحلول = 1 cal/gr 0C
محاسبات:
1- تعیین گرمای واکنش سود جامد در آب :
(دمای آب) T1 = 27 0C
∆T = 4 0C
(دمای آب + سود) T2 = 31 0C
ارلن m = 126.5 gr
آب m = 174.8 – 126.5 = 48.3 gr
ارلن+آب m =174.8 gr
Q = ∆T (mcارلن + mcآب) = 4 0C (126.5gr× 0.2 cal/gr + 48.3 gr × 1 cal/gr)
Q = 294.4 cal
2- تعیین گرمای واکنش سود جامد در محلول اسید کلریدریک :
(دمای اسید) T1 = 26.5 0C
∆T = 4 0C
(دمای اسید + سود) T2 = 30.5 0C
ارلن m = 126.5 gr
اسید m = 176.7 – 126.5 = 50.2 gr
ارلن+اسید m =176.7 gr
Q = ∆T (mcاسید + mcسود+ mcارلن) = 4 0C (50.2gr× 1+ (1× 1) + 126.5× 0.2)
Q = 306 cal
3- تعیین گرمای خنثی شدن محلول سود در محلول اسید کلریدریک :
T1 =25.5 0C
∆T = 2 0C
T2 = 27.5 0C
ارلن m = 126.5 gr
اسید m = 176.7 – 126.5 = 50.2 gr
سودm = 50.49gr
Q = ∆T (mcاسید + mcسود+ mcآب) = 2 0C (50.2gr× 1+ (50.49× 1) + 126.5× 0.2)
Q = 251.98 cal
نتیجه گیری:
از این آزمایش می توان نتیجه گرفت که هر چه ظرفیت گرمایی یک ماده بیشتر باشد، آن جسم دیرتر گرم شده و وقتی گرم شد دیرتر سرد می شود که مقدار آن ثابت بوده واین امر برمقدار گرمای واکنش تاثیر گذار است.
منابع خطا:
• خطا در نشان دادن اعداد و ارقام توسط دما سنج و خطا در خواندن آنها.
• عدم اندازه گیری دما بلا فاصله پس از واکنش که در اثرافت دمای واکنش خطا در اندازه گیری دما بوجود می آید.
منابع و ماخذ:
• کتاب شیمی فیزیک / اتکینز / غ- پارسافر و جلد اول: ترمودینامیک محمد مهدی منتظر رحمتی
این متن ناقص است برای مشاهده متن کامل آن را دانلود نمایید.
در صورت خراب بودن لینک دانلود " در قسمت نظر دهید " به ما اطلاع دهید تا مشکل را رفع کنیم
حجم فایل : 50 کیلو بایت | فرمت فایل : Docx | زبان : فارسی
دانلود مستقیم | پسورد فایل : kimiagari.ir

گزارش کار بمب کالریمتر جهت تعیین آنتالپی - یکشنبه هشتم مرداد 1391
گزارش کار تعیین مرتبه و ثابت سرعت واکنش - یکشنبه هشتم مرداد 1391
گزارش کار تعیین ضریب انبساط حجمی مایعات - یکشنبه هشتم مرداد 1391
گزارش کار تعیین سختی کل آب - شنبه هفتم مرداد 1391
گزارش کار دبي سنجی سيالات - جمعه ششم مرداد 1391
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 229
آرشیو مطالب
- اسفند 1386
- مهر 1386
- آبان 1386
- دی 1387
- بهمن 1387
- اسفند 1387
- فروردين 1387
- خرداد 1387
- مهر 1387
- آبان 1387
- آذر 1387
- بهمن 1388
- اسفند 1388
- فروردين 1388
- ارديبهشت 1388
- خرداد 1388
- تير 1388
- شهريور 1388
- آبان 1388
- بهمن 1389
- اسفند 1389
- فروردين 1389
- ارديبهشت 1389
- خرداد 1389
- تير 1389
- شهريور 1389
- مهر 1389
- آبان 1389
- دی 1390
- بهمن 1390
- اسفند 1390
- فروردين 1390
- ارديبهشت 1390
- خرداد 1390
- مرداد 1390
- شهريور 1390
- مهر 1390
- آبان 1390
- آذر 1390
- دی 1391
- بهمن 1391
- اسفند 1391
- فروردين 1391
- ارديبهشت 1391
- تير 1391
- مرداد 1391
- شهريور 1391
- مهر 1391
- آبان 1391
- آذر 1391
- بهمن 1392
- اسفند 1392
- فروردين 1392
- تير 1392
- مرداد 1392
- شهريور 1392
- آبان 1392
لینک دوستان
- کرم سفید کننده وا
- دانلود آهنگ جدید
- خرید گوشی
- فرش کاشان
- بازار اجتماعی رایج
- خرید لایسنس نود 32
- هاست ایمیل
- خرید بانه
- خرید بک لینک
- کلاه کاسکت
- موزیک باران
- دانلود آهنگ جدید
- ازن ژنراتور
- نمایندگی شیائومی مشهد
- مشاوره حقوقی تلفنی با وکیل
- کرم سفید کننده واژن
- اگهی استخدام کارپ
- دانلود فیلم
- آرشیو مطالب
- فرش مسجد
- دعا
- لیزر موهای زائد
- رنگ مو
- شارژ

