- نحوه ی دسترسی به پایان نامه های دانشگاه های مختلف جهان
- کاغذ لیتموس برای شناسایی غذاهای فاسد
- وجود سلنیم در خون مادر از ورود سم به بدن جنین جلوگیری میکند
- تعادل شیمیایی-شیمی تجزیه
- اثزدما بر تعادل-شیمی تجزیه رشته صنایع شیمیایی
- اثر دما بر انحلال پذیری-شیمی تجزیه رشته صنایع شیمیایی
- آدرس فیسبوک سایت
- چگونه برف درست کنيم
- دودزا
- نارنجک با پرمنگنات پتاسيم
آخرین مطالب
برای دریافت پایان نامه های دانشگاه های گوناگون میتوانید به لینک های زیر مراجعه نموده و براحتی متن کامل پایان نامه های کارشناسی ارشد و دکتری دانشگاه های مختلف جهان را دریافت کنید:
کتابخانه های دانشگاه های استرالیایی CAUL:
http://adt.caul.edu.au/
آرشیو دانشگاهی آنلاین DiVA... این پایگاه شامل متن کامل پایان نامه های نوشته شده در بخش تحصیلات تکمیلی 34 دانشگاه و کالج است:
http://www.diva-portal.org/smash/search.jsf
پایگاه علمی Open thesis... پایگاهی شامل متن کامل پایان نامه های گوناگون دانشگاه های مختلف و معتبر جهان:
http://www.openthesis.org
سایت رشته صنایع شیمیایی...
برچسب : پایان نامه,پایان نمامه شیمی,صنایع شیمیایی,رشته صنایع شیمیایی, نویسنده : علیرضا فرزادنیا chemis بازدید : 1591 تاريخ : 26 اسفند 1392 ساعت: 16:44
دانشمندان در ایالات متحده حسگر فلورسانس ارزان قیمتی را برای غذاهای فاسد ایجاد کردن که می تواند به آسانی یک کاغذ لیتموس مورد استفاده قرار گیرد.( کاغذ لیتموس: کاغذی است که به صورت نوارهای باریک در بازار موجود است و برای تشخیص باز و اسید به کار برده می شود.)
تاریخ مصرف درج شده بر روی مواد غذایی می تواند بهترین راهنما برای مصرف کننده باشد که آیا این غذا هنوز هم قابل خوردن است یا خیر. هر چند که سختگیری برای این تاریخها ناصحیح می باشد و این امر موجب می شود تا مقادیر هنگفتی از غذا به صورت زباله درآید. همانطور که در سوپر مارکتها ( و تعدادی از اتلاف کننده ها) هر آنچه که تاریخ مصرفش گذشته باشد، دور ریخته می شود. بدون توجه به آنکه آیا در حقیقت این غذا فاسد شده است یا خیر.
دانشمندان در ایالات متحده حسگر فلورسانس ارزان قیمتی را برای غذاهای فاسد ایجاد کردن که می تواند به آسانی یک کاغذ لیتموس مورد استفاده قرار گیرد.( کاغذ لیتموس: کاغذی است که به صورت نوارهای باریک در بازار موجود است و برای تشخیص باز و اسید به کار برده می شود.)
تاریخ مصرف درج شده بر روی مواد غذایی می تواند بهترین راهنما برای مصرف کننده باشد که آیا این غذا هنوز هم قابل خوردن است یا خیر. هر چند که سختگیری برای این تاریخها ناصحیح می باشد و این امر موجب می شود تا مقادیر هنگفتی از غذا به صورت زباله درآید. همانطور که در سوپر مارکتها ( و تعدادی از اتلاف کننده ها) هر آنچه که تاریخ مصرفش گذشته باشد، دور ریخته می شود. بدون توجه به آنکه آیا در حقیقت این غذا فاسد شده است یا خیر.
حسگرهای دقیقی برای شناسایی غذاهای فاسد بکار برده شده اند. مانند آنهایی که به بینی های الکترونیک معروفند ویا دیگر حسگرهای فلورسانس که آنها اغلب شامل دستورالعملهای طاقت فرسا و پیچیده ای می باشند. و در نتیجه آنها برای کاربردهای وسیع و جهانی مناسب نیستند.
اریک کول و گروهش در دانشگاه استنفورد کالیفرنیا، حسگر ساده و ارزان قیمتی ایجاد کرده اند. که می تواند مقدار این زباله های غذایی ناشی از در نظر گرفتن پا فشارانه ی تاریخ مصرف را کاهش دهد. آنها بارها الیگو دواکسی فلورسایدهایی (ODF : فلوروفورهای متصل شده به یک رشته بلند DNA ) را بکار بردند و آنها در اثر تهییج نور فرابنفش و در حضور ماده گازی مورد تجزیه که توسط باکتری یا کپک ایجاد می شود، تغییر رنگ می دهند. و این پاسخی فلورسانی می باشد که نشان می دهد ماده غذایی مورد نظر فاسد شده است.
بعلاوه، این رنگینه ها را می توان با استفاده از پرینترهای جوهر افشان تجاری بر روی کاغذ چاپ کرد و در نتیجه می توان به راحتی از آنها در حجم گسترده ای همانند کاغذهای لیتموس استفاده کرد.
هایوکین کاون که یکی از محققان پروژه می باشد، می گوید: " اقسام مختلفی از محلولهای جوهری ODF را می توان ایجاد کرد که بطور مثال یکی از آنها به گوشت فاسد حساس باشد، دیگری به کپک حساسیت داشته باشد و غیره ... . و آنها را در کارتریج (مخزن جوهر) پرینتر جوهر افشان تجاری ریخت و پس از آن بر روی کاغذ چاپ کرد و داخل ظرف غذا و یا محصولات قرار داد و از فساد آن باخبر شد." " این حسگرها می تواند پرینت شود و به صورت نوارهای باریک تست غذا فروخته شود."
اینگ لیو، که فردی با تجربه در شیمی زیست تجزیه ای (شیمی بیوآنالیتیکی) می باشد این روش جدید را می ستاید، مخصوصا استفاده از پرینترهای جوهر افشان را مورد توجه قرار می دهد. و او می گوید : " افراد دیگری که حسگرهای غذایی را ایجاد کرده وتوسعه می دهند هنوز در این سطح نیستند." همچنین اشاره می کند که "این روش منجر به تولید حسگرهای ارزانتر از انواع دیگر آن می شود." با وجود این او اشاره می کند که هنوز این حسگرها نیاز به تحقیق و توسعه بیشتری دارند که از آن جمله می توان زیاد کردن حساسیت آنها را نام برد. و او می گوید: " آنچه به عنوان حسگر غذا استفاده می شود باید واقعاً حساس و مشخص نما باشد و اینکه ما بگوییم غذا دارای سولفور یا نیتروژن متابولیت است، مشخص نمایی کافی را ندارد و تعیین نمی کند که کدام یک موجود است. "
کول و گروهش پذیرفتند که این مورد زمینه ای است برا ی کاربیشتر بر روی این حسگر و آنها تحقیق برای بدست آوردن الیگومرهای مناسبتر از زنجیره بزرگ الیگودواکسی فلورساید را مورد نظر قرار دادند. تا بتوانند بخوبی تشخیص دهند که چه ماده خاصی بر روی تغییر فلورسانس اثر می گذارد.
بعلاوه، آنها به فکر پایدار تر کردن جوهر ایجاد شده و همچنین پایدارتر کردن پاسخهای این حسگر می باشند.
سایت رشته صنایع شیمیایی...برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 1016 تاريخ : دوشنبه 26 اسفند 1392 ساعت: 18:0 ت
| محققان فنلاندی در دانشگاه کیوپیو ، با بررسی نمونههای خون زنان باردار به این نتیجه رسیدهاند که ماده سلنیم موجود در خون آنان ، در حفاظت از جنین در برابر فلزات سمی سنگین ، مثل کادمیم که در دود سیگار یافت میشود، موثر است. این محققان در آزمایشهای خود مشاهده کردند که مقدار سلنیم موجود در بند ناف که مستقیما به بدن جنین وارد میشود، بیش از میزان این ماده در بدن خود زنان باردار است و با بالا رفتن میزان یک ماده سمی نظیر کادمیم در بند ناف ، بر میزان سلنیم نیز افزوده میشود. |
| محققان فنلاندی در دانشگاه کیوپیو ، با بررسی نمونههای خون زنان باردار به این نتیجه رسیدهاند که ماده سلنیم موجود در خون آنان ، در حفاظت از جنین در برابر فلزات سمی سنگین ، مثل کادمیم که در دود سیگار یافت میشود، موثر است. این محققان در آزمایشهای خود مشاهده کردند که مقدار سلنیم موجود در بند ناف که مستقیما به بدن جنین وارد میشود، بیش از میزان این ماده در بدن خود زنان باردار است و با بالا رفتن میزان یک ماده سمی نظیر کادمیم در بند ناف ، بر میزان سلنیم نیز افزوده میشود. این امر حکایت از آن دارد که بندناف ، سلنیم بیشتری را از بدن مادر جذب میکند، تا کادمیمی را که در آستانه ورود به بدن جنین است، پاک کند. محققان فنلاندی در مطالعه روی زنان حامله در استونی مشاهده کردهاند، آن دسته از خانمهای بارداری که در غذای مصرفی آنها ، مقدار سلنیم کمتر از حد متعارف است، در ماههای آخر بارداری تراز این ماده در خونشان تا حدود 15 درصد افت میکند. |
سایت رشته صنایع شیمیایی...
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 796 تاريخ : دوشنبه 7 بهمن 1392 ساعت: 0:17 ت
در مطالب قبل به ویژگی های سیستمهای در حال تعادل اشاره کردیم و با
ثابت تعادل آشنا شدیم...
حال میخواهیم بدانیم آیا میتوانیم واکنش را به دلخواه خودمان کنترل کنیم؟
جواب مثبت است!
برای اینکه محصول بیشتری تولید کنیم و یا بازده واکنش را بالا ببریم، میتوانیم
تغییرات زیر را در سیستم واکنش ایجاد کنیم:
- تغییر غلظتهای واکنش دهندهها یا محصولات
- تغییر دما
- تغییر فشار و حجم (برای یک واکنش در فاز گازی)
![[تصویر: 20111224154637397_0027.gif]](http://img.tebyan.net/big/1390/10/20111224154637397_0027.gif)
کنترل یک واکنش:
در مطالب قبل به ویژگی های سیستمهای در حال تعادل اشاره کردیم و با
ثابت تعادل آشنا شدیم...
حال میخواهیم بدانیم آیا میتوانیم واکنش را به دلخواه خودمان کنترل کنیم؟
جواب مثبت است!
برای اینکه محصول بیشتری تولید کنیم و یا بازده واکنش را بالا ببریم، میتوانیم
تغییرات زیر را در سیستم واکنش ایجاد کنیم:
- تغییر غلظتهای واکنش دهندهها یا محصولات
- تغییر دما
- تغییر فشار و حجم (برای یک واکنش در فاز گازی)
![[تصویر: 20111224154637397_0027.gif]](http://img.tebyan.net/big/1390/10/20111224154637397_0027.gif)
در واکنشهای تعادلی، هر تغییری در سیستم صورت گیرد، سیستم سعی خواهد
کرد به سمتی پیش رود که باز هم حالت تعادل را برقرار کند. تغییرات ذکر شده در
بالا نیز حالت تعادلی سیستم را به طور موقت بر هم می زنند.
اصل لوشاتلیه:
حالت تعادل در هر سیستمی به عوامل موجود در سیستم مانند دما، فشار و غلظت
اجزای مختلف بستگی دارد. این عوامل، پارامتر یا متغیرهای واکنش نامیده میشوند.
یک تغییر در هر کدام از پارامترهای واکنش، ممکن است وضعیت تعادلی سیستم
را تحت تأثیر قرار دهد.
قاعدهی کلی که میتواند تأثیر تغییرات این پارامترها را بر روی حالت تعادل توصیف
کند، توسط اچ. لوشاتلیه (1885) و اف. بارون (1886) فرمولبندی شده ولی بطور
مشترک، اصل لوشاتلیه نامیده میشود.
این اصل، کاربرد سودمند بزرگی برای تمام سیستمهای فیزیکی و شیمیایی دارد.
این اصل بیان میکند هر سیستمی که در معرض تغییری در پارامترهای خود قرار
میگیرد، فرایندهایی در سیستم اتفاق میافتد که با تغییر اولیه مخالفت کنند؛
بنابراین سیستم به یک وضعیت تعادلی جدید میرسد.
تغییر غلظت واکنشدهندهها یا محصولات:
یک سیستم شیمیایی در حال تعادل در نظر بگیرید. اگر تعادل با تغییر غلظت هر
کدام از اجزای واکنش به هم بخورد، تعادل به جهتی انتقال پیدا خواهد کرد که
سعی در برگرداندن سیستم به وضعیت اصلیاش خواهد کرد. به مثال زیر توجه
کنید:
![[تصویر: 20111224154637413_0028.gif]](http://img.tebyan.net/big/1390/10/20111224154637413_0028.gif)
سیستمی از مخلوط 5 مولکول ایزوبوتان و 2 مولکول بوتان در حال تعادل است.
با اضافه کردن هفت ایزوبوتان دیگر، سیستم از حالت تعادل خارج میشود.
شبکهای از دو مولکول ایزوبوتان به مولکول بوتان تغییر میکند تا بازهم مخلوطی
به دست آید که حالت تعادلی برقرار شود. نسبت ایزوبوتان به بوتان، 5 به 2 است.
![[تصویر: 20111224154637428_0029.gif]](http://img.tebyan.net/big/1390/10/20111224154637428_0029.gif)
در واکنش زیر، افزودن BaCl2 باعث جابجاشدن مسیر تعادل در مسیر رفت خواهد
شد تا وضعیت تعادلی جدید برقرار شود:
![[تصویر: 20111224154637444_0030.gif]](http://img.tebyan.net/small/1390/10/20111224154637444_0030.gif)
در واکنش زیر افزودن Cl2 به حالت تعادل سیستم، باعث جابجا شدن مسیر تعادلی
سیستم در جهت برگشت خواهد شد:![[تصویر: 20111224154637460_0031.gif]](http://img.tebyan.net/small/1390/10/20111224154637460_0031.gif)
به نظر شما با این افزایش Cl2 چه اتفاقی برای غلظت CO خواهد افتاد؟
اثر حجم:
اگر یک سیستم گازی متراکم شود، فشار افزایش پیدا میکند و باعث میشود سیستم
با یک شیفت (جابجایی) در جهت مولکولهای گازی کمتر تا اندازهای از فشار و تغییر
ایجاد شده رهایی پیدا کند.
در حالتی که سیستم منبسط شود، فشار کاهش پیدا میکند و یک شیفت در جهت
مولکولهای گازی بیشتر تا اندازهای به حالت تعادلی اولیه باز میگردد.
![[تصویر: 20111224154637460_0032.gif]](http://img.tebyan.net/big/1390/10/20111224154637460_0032.gif)
در شکل بالا، گاز N2O4 با NO2 در حال تعادل است:![[تصویر: 20111224154637522_0033.gif]](http://img.tebyan.net/small/1390/10/20111224154637522_0033.gif)
ابتدا نسبت N2O4 به NO2، مقدار 1 به 2 است (1:2) . سپس حجم سیستم به یک سوم
حجم اولیه کاهش مییابد (سیستم متراکم میشود) و برای اینکه سیستم به تعادل
دوباره برسد، واکنش به سمتی جابجا میشود که این فشار افزایش یافته را کم کند (جهتی
که تعداد مولکولها را کاهش دهد)؛ بنابراین تعادل دوباره برقرار میشود (نسبت N2O4 به
NO2 اکنون 4:5 است).
جابجایی مسیر تعادل با تغییر دمای سیستم:
با یک مثال این بحث را شروع میکنیم؛ زمانی که یک مول گاز استیلن با دو مول گاز هیدروژن
واکنش نشان دهد، یک مول گاز اتان تشکیل میشود و 311 کیلوژول انرژی آزاد میکند؛ بنابر
این یک واکنش گرماده است.
گرما، محصول دیگر این واکنش است:![[تصویر: 20111224154637538_0034.gif]](http://img.tebyan.net/small/1390/10/20111224154637538_0034.gif)
ΔH=-311KJ به معنای آزاد شدن 311 کیلوژول انرژی گرمایی از این واکنش است.
در واکنشهای گرماده که با فرمول کلی:![[تصویر: 20111224154637538_0035.gif]](http://img.tebyan.net/small/1390/10/20111224154637538_0035.gif)
مشخص میشوند، افزودن گرما و حرارت دادن به سیستم باعث جابجایی مسیر تعادل در
جهت برگشت میشود (یعنی واکنش دهندهی بیشتر). به همین ترتیب، برداشتن حرارت
و گرما از سیستم باعث جابجایی تعادل در مسیر رفت میشود (تا محصول بیشتری تولید
کند).
به مثال زیر توجه کنید:![[تصویر: 20111224154637538_0036.gif]](http://img.tebyan.net/small/1390/10/20111224154637538_0036.gif)
با کاهش دمای سیستم در این واکنش گرماده (برداشتن حرارت از سیستم)، مسیر
رفت واکنش تعادلی، پیشرفت میکند تا محصول بیشتری تولید شود!
در واکنشهای گرماگیر که با فرمول کلی: ![[تصویر: 20111224154637553_0038.gif]](http://img.tebyan.net/small/1390/10/20111224154637553_0038.gif)
مشخص می شوند، افزودن حرارت به سیستم باعث جابجایی و شیفت تعادل به سمت
رفت واکنش می شود (محصول بیش تری تولید می شود) و برداشتن حرارت و کم شدن
دمای سیستم باعث شیفت تعادل به سمت برگشت می شود (واکنش دهنده ی
بیش تر). به مثال زیر توجه کنید:![[تصویر: 20111224154637553_0037.gif]](http://img.tebyan.net/small/1390/10/20111224154637553_0037.gif)
با افزایش دمای سیستم در این واکنش گرماگیر، واکنش در جهت رفت پیش میرود
تا اکسیژن و هیدروژن بیشتری تولید کند.
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 375 تاريخ : شنبه 4 آبان 1392 ساعت: 16:7 ت
![[تصویر: 361804140229692481182192507023742089163.gif]](http://img.tebyan.net/big/1389/05/361804140229692481182192507023742089163.gif)
حالت تعادلی در هر سیستمی به وجود فاکتورهایی در آن سیستم بستگی دارد. مثل دما، فشار و غلظت گونه های مختلف. این فاکتورها، متغیرها و یا پارامترهای واکنش نامیده می شوند. تغییر در هر کدام یک از این پارامتر ها می تواند بر روی موقعیت تعادل تأثیر گذار باشد. قاعده ی کلی که می تواند اثر تغییرات در این پارامتر ها را بر روی حالت تعادلی توضیح دهد، در سال 1885 توسط اچ لوشاتلیه ( H.Le Chatelie ) و اف براوون ( F.Braun ) در سال 1886، فرمول بندی شد. اما به طور معمول این قاعده به نام اصل لوشاتلیه نامیده می گردد.
![[تصویر: 251102401902217818165832456322894125122227.gif]](http://img.tebyan.net/big/1389/05/251102401902217818165832456322894125122227.gif)
![[تصویر: 361804140229692481182192507023742089163.gif]](http://img.tebyan.net/big/1389/05/361804140229692481182192507023742089163.gif)
حالت تعادلی در هر سیستمی به وجود فاکتورهایی در آن سیستم بستگی دارد. مثل دما، فشار و غلظت گونه های مختلف. این فاکتورها، متغیرها و یا پارامترهای واکنش نامیده می شوند. تغییر در هر کدام یک از این پارامتر ها می تواند بر روی موقعیت تعادل تأثیر گذار باشد. قاعده ی کلی که می تواند اثر تغییرات در این پارامتر ها را بر روی حالت تعادلی توضیح دهد، در سال 1885 توسط اچ لوشاتلیه ( H.Le Chatelie ) و اف براوون ( F.Braun ) در سال 1886، فرمول بندی شد. اما به طور معمول این قاعده به نام اصل لوشاتلیه نامیده می گردد.
![[تصویر: 251102401902217818165832456322894125122227.gif]](http://img.tebyan.net/big/1389/05/251102401902217818165832456322894125122227.gif)
این اصل بدین صورت بیان می گردد که اگر یک سیستم در حالت تعادل در معرض تغییر در یک یا متغیرهای بیشتری نظیر فشار، دما و یا غلظت قرار گیرد، تعادل در مسیری جابه جا می شود که اثر آن تغییر را خنثی کند. اصل لوشاتلیه، اصل تعادل متحرک و یا سیار نیز نامیده می شود. زمانی که اثر تغییر اعمال شده بر روی سیستم، روی تعادل همان سیستم اثر می گذارد، می توان نشان داد که اصل لوشاتلیه نیز می تواند در پیشگویی مراحل واکنش به شکل کیفی مفید واقع شود.
اگر یک سیستم در حالت تعادل در معرض تغییر در یک یا متغیرهای بیشتری نظیر فشار، دما و یا غلظت قرار گیرد، تعادل در مسیری جابه جا می شود که اثر آن تغییر را خنثی کند. اصل لوشاتلیه، اصل تعادل متحرک و یا سیار نیز نامیده می شود.اثر تغییر دما:
![[تصویر: 1852512451181351001632471020820972197143238188.gif]](http://img.tebyan.net/big/1389/05/1852512451181351001632471020820972197143238188.gif)
بر طبق اصل لوشاتلیه، زمانی که دما یا گرمای موجود در سیستم در حالت تعادل افزایش می یابد، سیستم بایستی در مسیری حرکت کند تا گرمای افزوده شده را به طور کامل تحلیل برد ( خنثی کردن اثر افزایش دما ).
بنابراین افزایش دمای یک سیستم شیمیایی در حالت تعادل، یک واکنش گرماگیر را نشان می دهد. یعنی واکنشی که با جذب گرما، انجام می شود. از طرف دیگر، اگر دمای سیستم تحت شرایط فشار و حجم ثابت کاهش یابد، تعادل در جهتی جا به جا خواهد شد که منجر به تولید مقداری گرما شود. کاهش در دمای یک سیستم در حالت تعادل، یک واکنش گرماده را نشان می دهد یعنی واکنشی که در ضمن آن گرما از دست می رود. برای مثال واکنش زیر را بررسی می کنیم.
واکنش در مسیر رفت (رو به جلو) گرماده و در مسیر برگشت (رو به عقب) گرما گیر می باشد. اگر دمای سیستم تعادلی افزایش یابد، بر طبق اصل لوشاتلیه تعادل در جهتی جا به جا خواهد شد که اثر دمای اعمال شده را خنثی کند یعنی واکنش گرماگیر صورت می گیرد و تعادل به سمت چپ (واکنش گرها) جا به جا می شود. در واقع در این جا مقداری از آمونیاک تجزیه می شود. از طرف دیگر زمانی که دمای سیستم تعادل کاهش می یابد، واکنش گرماده صورت می گیرد. یعنی تعادل در جهتی جا به جا خواهد شد که گرمای از دست رفته را تولید کند. بنابراین واکنش به سمت رفت و یا به سمت راست (تولید آمونیاک) جا به جا خواهد شد.
بنابراین می توان نتیجه را به صورت زیر نشان داد:
افزایش دما تعادل را به سمت واکنش گرماگیر و کاهش دما، تعادل را به سمت واکنش گرماده جا به جا می کند.
بررسی قابلیت حل شدن نسبت به دما:
در مورد موادی که انحلال آنها گرماده است با افزایش دما قابلیت حل شدن کاهش می یابد در نتیجه حرکت نمودار نزولی خواهد بود اما در مورد موادی که انحلال آنها گرماگیر است با افزایش دما قابلیت حل شدن افزایش می یابد لذا حرکت نمودار صعودی خواهد بود. در مورد NaCl و NaBr نیز با افزایش دما تغییر چندانی در قابلیت حل شدن ایجاد نمی شود لذا حرکت نمودار در مورد این دو نمک تقریباً به صورت افقی است.
جهت یادگیری بیشتر می توانید در این جا کلیک کنید.
در فیلم مزبور دو واکنش مورد بررسی قرار می گیرد.
- واکنش ترکیب گاز هیدروژن با گاز ید:
که در این جا ابتدا اثر افزایش غلظت و اثر یک گاز مثل هلیوم بر روی واکنش مورد بررسی قرار می گیرد اما در مرحله ی بعد که مدنظر است اثر تغییرات دما بر روی واکنش می باشد که در این جا چون واکنش تشکیل هیدروژن یدید گرماده است با افزایش دما واکنش به سمت چپ جابه جا می شود تا طبق اصل لوشاتلیه اثر آن افزایش را خنثی کند. بنابراین رنگ بنفش ظرف مخلوط بیشتر خواهد شد چرا که ید بیشتری تولید می شود اما با کاهش دما، رنگ ظرف به بی رنگی متمایل می شود تا HI را تولید کند.
- واکنش تعادلی دی اکسید نیتروژن (قهوه ای رنگ) با تترااکسید دی نیتروژن (بی رنگ):
![[تصویر: 157167159782247322911215714215423912579153.gif]](http://img.tebyan.net/big/1389/05/157167159782247322911215714215423912579153.gif)
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 362 تاريخ : جمعه آبان 1392 ساعت: 16:5 ت
Na2CO3 , Li2CO3) بدین گونه عمل میکنند. علاوه بر این ، انحلال پذیری تمام گازها با افزایش دما ، کاهش پیدا میکند. مثلا با گرم کردن نوشابههای گازدار ،
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 378 تاريخ : پنجشنبه 2 آبان 1392 ساعت: 16:4 ت
طی درخواست های کاربران آدرس فیسبوک سایت نیز را اندازی شد.
که در آن استخدام های روز شیمی و مطالب مرتبط با شیمی و صنایع شیمیایی قرار میګیرد.
به امید موفقیت های بیشتر - تیم مدیریت سایت کیمیاګری
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 506 تاريخ : دوشنبه 11 شهريور 1392 ساعت: 2:57 ت
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 372 تاريخ : جمعه 8 شهريور 1392 ساعت: 23:4 ت
۱. هگزاکلراتان
۲.منيزيم(پودر)
۳.نفتالين
دودزای زرد
۱.کلرات پتاسيم
۲.اورامين
۳.جوش شيرين
۴.گوگرد
فلاش ( خطرناکه )
۱. نيترات پتاسيم
۲.پودر آلومينيم
۳.پودر آهن
طلای مذاب ( بسیار زيبا)
۱. يديد پتاسيم
۲. نيترات سرب
بعد از مخلوط کردن با آب جوشانده شود و مجددا خنک گردد.
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 403 تاريخ : پنجشنبه 7 شهريور 1392 ساعت: 23:3 ت
مطلب بصورت موقت و بدون نمایش در وبلاگ ثبت شده است
پرمنگنات پتاسيم ماده اي است که در حالت خشک به صورت بلورهاي ارغواني در مغازه هاي عطاري و داروخانه ها به عنوان ماده ضد عفوني کننده فروخته ميشود. پرمنگنات ماده اي است اکسيد کننده و به همين دليل ميتواند به عنوان يکي از دو جز مواد منفجره (ماده اکسيد کننده + ماده سوختي) استفاده شود. براي درست کردن نارنجک پرمنگناتي, يک ظرف شيشه اي دردار, مثل ظرفهاي سس مايونز را برداريد و درون آن چند قطره بنزين بريزيد و درب آنرا ببنديد و شيشه را تکان بدهيد تا تمام سطح درون شيشه آغشته به بنزين شود. درب شيشه را باز کنيد و بنزين اضافي را بيرون بريزيد. سپس چند قطره محلول پرمنگنات پتاسيم (محلول در آب) را درون شيشه بچکانيد و درب ظرف را محکم ببنديد بطوري که بخار بنزين از آن خارج نشود. براي منفجر کردن کافيست شيشه را پرتاب کنيد. ظرف را بسيار دور پرتاب کنيد و سعي کنيد پناه بگيريد. اين نارنجک بسيار خطرناک است و به اندازه نصف يک ديناميت قدرت دارد. اصلاً با آن شوخي نکنيد. نگهداري طولاني مدت اين بمب توصيه نميشود. حداکثر چند ساعت بعد از ساخت از آن استفاده کنيد. سایت رشته صنایع شیمیایی...برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 434 تاريخ : پنجشنبه 7 شهريور 1392 ساعت: 23:2 ت
شده ايم، اما در اينجا مي خواهم به شما كوه آتشفشاني آموزش بدهم
كه بطور خود به خود و ناگهاني مشتعل مي شود.
اكثر ما از ديدن آزمايش كوه آتشفشان در دوره راهنمايي بسيار متعجب
شده ايم، اما در اينجا مي خواهم به شما كوه آتشفشاني آموزش بدهم
كه بطور خود به خود و ناگهاني مشتعل مي شود.
مواد و وسايل لازم:
سطح نسوز
پتاسيم پرمنگنات
گليسرين.
پتاسيم پرمنگنات يك ضدعفوني كننده قوي مي باشد كه مي توان آن
را از داروخانه ها تهيه نمود. گليسيرين نيز در سوپر ماركت ها به راحتي
قابل خريد است.
انحلال اين دو ماده در هم با واكنشي گرما زا همراه است كه باعث
ايجاد شعله مي شود. اشتعال اين دو ماده بسيار پر انرژي و سريع
است.
به اندازه يك قاشق پتاسيم پرمنگنات را بر روي يك سطح نسوز ريخته،
از نبودن مواد و وسايل قابل اشتعال در محيط مطمئن شده و سپس
مقداري گليسرين روي آن بريزيد. چنانچه دماي محيط در حدود ۲۵ درجه
سانتيگراد باشد، اشتعال خود به خود ناگهاني خواهيم داشت.
البته اين اشتعال بعد از مدت كوتاهي روي مي دهد كه شما مي توانيد
براي هيجان زده كردن دوستانتان در اين حين با آنها شروع به صحبت نموده
و حواسسشان را پرت نماييد.
توجه داشته باشيد كه دود حاصل از اين آزمايش تقريباً سمي است
و از استنشاق آن بايد خودداري نمود. سایت رشته صنایع شیمیایی...
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 387 تاريخ : چهارشنبه 6 شهريور 1392 ساعت: 23:0 ت
این گزارش کار به درخواست آقای غلامحسین نظری نکوهی تهیه شده است.
در صورت خراب بودن لینک دانلود " در قسمت نظر دهید " به ما اطلاع دهید تا مشکل را رفع کنیم
حجم فایل : 242 کیلو بایت | فرمت فایل : PDF | زبان : فارسی
دانلود مستقیم | پسورد فایل : kimiagari.ir

برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 354 تاريخ : دوشنبه 4 شهريور 1392 ساعت: 21:16
این گزارش کار به درخواست آقای غلامحسین نظری نکوهی تهیه شده است.
در صورت خراب بودن لینک دانلود " در قسمت نظر دهید " به ما اطلاع دهید تا مشکل را رفع کنیم
حجم فایل : 190 کیلو بایت | فرمت فایل : PDF | زبان : فارسی
دانلود مستقیم | پسورد فایل : kimiagari.ir

برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 535 تاريخ : دوشنبه 4 شهريور 1392 ساعت: 12:35
با رتبه خوب و اونایی هم که تنبلی کردن هم قبول میشن البته شبانه(مثل خودم)خخخخخ
اونایی که کنکور صنایع شیمیایی امتحان داشتن خیلی نترسن چون همتون قبول میشین حالا فوقش شبانه ....
ایشالا که همتون موفق باشین...
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 460 تاريخ : جمعه 25 مرداد 1392 ساعت: 17:1 ت

اما ماجرای این لوگوی عجیب چیست؟ در ادامه مطلب بخوانید ...

اما ماجرای این لوگوی عجیب چیست؟
امروز، ۱۲ آگوست، یکصد و بیست و ششمین سالروز تولد «اروین شروینگر» است. فیزیکدان اتریشی و یکی از دانشمندان فیزیک کوانتوم که کاشف مکانیک موج و البته مبدع معادله معروف «شرودینگر» و البته آزمایش معروف «گربه شرودینگر» است. شرودینگر به دلیل کشف مکانیک موج موفق شد همراه با «پل دیراک» جایزه نوبل فیزیک را از آن خود کرد.

معادله شرودینگر، معادله ای است که چگونگی تغییر حالت کوانتومی یک سامانه فیزیکی با زمان را توصیف می کند. این معادله در اواخر سال 1925 فرمول بندی شد و در سال 1926 به وسیله شرودینگر منتشر گردید. در مکانیک کلاسیک، معادله حرکت قانون دوم نیوتن است و فرمول بندی های معادل آن، معادله اویلر-لاگرانژ و معادله هامیلتون هستند. در همه این فرمول بندی ها، برای حل حرکت یک سیستم مکانیکی و پیشگویی ریاضی اینکه سامانه در هر زمان پس از شرایط و پیکربندی های اولیه سیستم چه حالتی خواهد داشت، استفاده می شوند.
گربه شرودینگر هم یک آزمایش فکری در فیزیک کوانتومی است که در سال ۱۹۳۵ توسط شرودینگر ابداع شد. سناریوی آزمایش درباره یک گربه است که بسته به یک رویداد تصادفی زودتر، ممکن است مرده باشد یا زنده.بر این اساس، این آزمایش، این طور طراحی شده است: فرض کنید گربهای در جعبهای دربسته زندانی است. در این جعبه یک شیشه گاز سیانور، یک چکش، یک حس گر پرتوزا و یک منبع پرتوزا نیز وجود دارد. ذرات پرتوزا بصورت نامنظم تابش میکنند و به همین دلیل برای آنها نیمه عمر در نظر میگیرند. حال فرض کنید حسگر و چکش طوری تنظیم شده باشند که در صورت تابش موج پرتوزا بین ساعت ۱۲ و ۱۲:۰۱، چکش شیشه حاوی گاز را شکسته و گربه بمیرد. اگر در ساعت ۱۲:۰۱ در جعبه را باز کنید چه خواهید دید؟ اگر از طریق فرمول نیمه عمر منبع، احتمال تابش بین ساعت ۱۲ و ۱۲:۰۱ را ۵۰٪ پیش بینی کنید. گربه داخل جعبه در هنگام برداشتن درب جعبه ۵۰٪ مردهاست و ۵۰٪ زنده است. اما وقتی درب جعبه را برمیدارید خواهید دید که گربه یا مرده و یا زنده است. نمیتوان گفت ۵۰٪ سلولهای بدن گربه مردهاند و ۵۰٪ آنها زندهاند. در فاصله یک لحظه، احتمال به یقین تبدیل خواهد شد. این امر کاملاً متضاد با مکانیک کوانتومی است. با این که گفته می شد هیچ گاه نمیتوان موقعیت یک سیستم را به دقت اندازهگیری کرد. اما در این مثال کاملاً این امر ممکن شده است.

شرودینگر ۴ ژانویه ۱۹۶۱ ،در وین، در سن ۷۳ سالگی به علت ابتلا به بیماری سل درگذشت.
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 397 تاريخ : سه شنبه 22 مرداد 1392 ساعت: 3:9
لوازم مورد نیاز :روغن داغ کن - یک لیوان بزرگ شیشه ای - یک ظرف متوسط
روش کار :مقداری اسید بوریک (8 قا شق چای خوری ) را دریک لیوان که تا نیمه آب دارد بریزید ومخلوط را به هم بزنید و دریک روغن داغ کن کوچک بریزید و بجو شا نید تا کا مل حل شود حا لا محلول را در یک لیوان بزرگ شیشه ای بریزید و لیوان را در یکظرف آب سرد قرار دهید. وقتی محلول سرد می شود با ریدن دانه ها ی برف شروع می شود.
چگونه کولاک برف شیمیایی درست کنیم *
مواد مورد نیاز:هشت قا شق چا یخوری اسید بوریک - نصف لیوان آب - آب یخ
لوازم مورد نیاز :روغن داغ کن - یک لیوان بزرگ شیشه ای - یک ظرف متوسط
روش کار :مقداری اسید بوریک (8 قا شق چای خوری ) را دریک لیوان که تا نیمه آب دارد بریزید ومخلوط را به هم بزنید و دریک روغن داغ کن کوچک بریزید و بجو شا نید تا کا مل حل شود حا لا محلول را در یک لیوان بزرگ شیشه ای بریزید و لیوان را در یکظرف آب سرد قرار دهید. وقتی محلول سرد می شود با ریدن دانه ها ی برف شروع می شود.
آنچه روي ميدهد:علت این کولاک برفی این است که آب داغ بیشتر از آب سرد اسید بوریک را در خود حل می کند. وقتی محلول داغ سرد می شود مقدارزیا دی اسید بوریک به صورت دانه های جا مد د ر می آید وچون نمی تواند درآب با قی بما ند از محلول جدا می شود.
البته بیشتر ازمایش هایی که اینجا میزارم شما خودتون میتونید انجام بدین و موادش به راحتی گیر میاد سایت رشته صنایع شیمیایی...
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 338 تاريخ : جمعه 18 مرداد 1392 ساعت: 3:44 ت
برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 306 تاريخ : شنبه 5 مرداد 1392 ساعت: 1:52 ت
دانلود پروژه امکان سنجی طرح تولید رنگ های صنعتی رزین
چکیده طرح : از اواخر دهه ۵۰ تعداد واحدهای تولیدکننده رنگ افزایش یافت و امروز صنعت رنگ کشور با بیـش از ۳۵۰ واحد صنعتی مجاز با مجموع ظرفیت ۹۰۰ هزارتن در سال تولید انواع رنگهای ساختمانی و صنعتی و همچنین صدها واحد غیر مجاز مشغول به فعالیت می باشد. صنعت تولید رزینهای مورد مصرف در رنگسازی نیز در کشور سابقه ای طولانی دارد. رزین پایه اصلی رنگ است و سایر اجزای رنگ به وسیله آن به یکدیگر و به سطح مورد نظر می چسبند. ضمنا رزین، با تشکیل فیلم، بعد از خشک شدن رنگ، باعث محافظت سطوح در برابر عوامل خارجی می شود. کیفیت یک رنگ به نوع رزین آن بستگی دارد. به همین دلیل است که پوشش ها و رنگ های مختلف را بر حسب نوع رزین آن طبقه بندی می کنند. واکنش تبدیل رنگ تر به یک فیلم جامد را که منحصرا به رزین مربوط می شود، خشک شدن می گویند.
فهرست:
تاریخچه صنعت رنگ و رزین ایران
جدول قیمت های ماهیانه این طرح
تعرفه گاز،برق،زمین در سال ۱۳۹۱
هزینه سرمایه
ظرفیت پیشنهادی ۳۰۰۰ تن در سال
شرایط واردات رنگ های صنعتی
شمای جریان تولید (pfd)
برآورد هزینه ها
برای دانلود فایل اینجا کلیک کنید
سایت رشته صنایع شیمیایی...برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 326 تاريخ : جمعه 4 مرداد 1392 ساعت: 16:9 ت
(این مقاله به درخواست سارا ذکاوتی در سایت قرار ګرفته است)
لوله ی آزمایش : لوله ای است برای نگه داری و گرم کردن محلول ها و مایعات و نباید در هنگام گرم کردن ان بیش از 3/1 ظرفیت آن را پر کرد. آن را ته گرد می سازند تا در برابر گرمای مستقیم آتش، نشکند.

برس لوله یا لوله شور: نوعی برس كه برای شستن وتمیز كردن دیواره ی درونی لوله ی آزمایش كاربرد دارد.برای شستن لوله آزمایش، برس را درون لوله آزمایش قرار می دهند و می چر خانند.

جا لوله ی آزمایش: وسیله ای چوبی،پلاستیكی یا فلزی كه برای نگهداری لوله آزمایش كاربرد دارد.
ادامه مطلب....
لوله ی آزمایش : لوله ای است برای نگه داری و گرم کردن محلول ها و مایعات و نباید در هنگام گرم کردن ان بیش از 3/1 ظرفیت آن را پر کرد. آن را ته گرد می سازند تا در برابر گرمای مستقیم آتش، نشکند.

برس لوله یا لوله شور: نوعی برس كه برای شستن وتمیز كردن دیواره ی درونی لوله ی آزمایش كاربرد دارد.برای شستن لوله آزمایش، برس را درون لوله آزمایش قرار می دهند و می چر خانند.

جا لوله ی آزمایش: وسیله ای چوبی،پلاستیكی یا فلزی كه برای نگهداری لوله آزمایش كاربرد دارد.

لوله گیر : وسیله ای فلزی یا چوبی كه برای نگهداری لوله آزمایش به هنگام گرم كردن (لوله گیر فلزی)و گرفتن آن (لوله گیر چوبی) به كار می رود.

لیوان آزمایشگاهی یا بشر: لیوان آزمایشگاهی که دارای دو نوع شیشه ای و پلاستیکی میباشد .از بشر برای برداشتن حجم معینی از مایعات و گرم کردن محلول ها ، تهیه محلول ها ، حل کردن مواد و انتقال محلول ها استفاده می گردد.بشر به اندازه های حجمی متفاوت موجود است. آن را روی سه پایه و توری نسوز قرار می دهند. برای تبخیر ،گرم كردن،صاف كردن وغیره... كاربرد دارد. با توجه به حجم آن مشخص می شود (مانند: 600 سی سی، 250 سی سی ، 1000 سی سی و ... )

ارلن مایر: ظرفی مخروطی شكل است كه برای گرم كردن محلول ها و مایعات و یا نگهداری آنها وهمچنین برای همزدن مخلوط ها كاربرد دارد. (مانند: 600 سی سی، 250 سی سی ، 1000 سی سی و ... )

قیف : وسیله ای شیشه ای ،پلاستیكی و ... برای انتقال مایع ها از ظرفی به ظرف دیگر همچنین در صاف كردن و ... به كار می رود.

قیف جداکننده (دکانتور) : از آن برای جدا کردن مایعاتی که مخلوط نشدنی اند همانند آب ونفت استفاده میشود.

شیشهی ساعت : برای تبخیرسریع مایعات و محلول ها استفاده میگردد.
|
بوته ی چینی : وسیله ای فلزی یا چینی كه برای سوزاندن و یا ذوب كردن مواد به كار می رود. آن را با انبر(یا پنس بوته) برداشته و روی سه پایه و مثلث نسوز قرار می دهند.

|

کپسول چینی : از آن برای تبخیر سریع محلول ها و برای ذوب کردن مواد استفاده میشود.

چراغ گازی(چراغ بونزن): به یاد مخترع آن بونزن (شیمیدان آلمانی )نامگذاری شده است. دارای دریچه ی هوا است که هنگامی که از آن استفاده نمی کنیم باید دریچه ی هوا را ببندیم تا آتش ، زرد رنگ و سردتر شده و دیده شود.

|
چراغ الكلی: گاهی به جای چراغ گازی به کار می رود. پیش از استفاده حتما باید فتیله را تا حدی درآوریم تا بخارهای الکل بیرون رود و چراغ منفجر نشود.

قاشقك (اسپاتول،كاردك) : وسیله ای است چینی یا فلزی ،مانند قاشق (با دو سر )كه برای برداشتن مواد جامد از ظرفی وانتقال آن به ظرف دیگر كاربرد دارد.

|
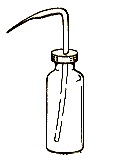
همزن شیشه ای: میله ی شیشه ای تو پر كه برای مخلوط كردن محلولها ویكنواخت كردن گرمای یك محل به كار می رود.

|
هاون چینی: برای له کردن و ساییدن مواد استفاده می شود. نباید دسته هاون را درون هاون بکوبیم.

بورت : یکی از وسایلی که برای اندازه گیری و برداشتن حجم معینی از مایعات به کار میرود. از متداول ترین انواع آن بورت شیردار است. براساس میلی لیتر درجه بندی میشود و صفر آن بالا ، 100آن در پایین قرار دارد.
|
بالن ته گرد : از این وسیله برای جوشاندن و تقطیر مایعات ، تهیه و تعیین چگالی گازها و ... استفاده میگردد. (مانند: 600 سی سی، 250 سی سی ، 1000 سی سی و ... )
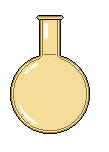
بالن ته صاف : بیشتر برای نگه داری مواد به کار می رود. کاربرد آن مانند ارلن است. (مانند: 600 سی سی، 250 سی سی ، 1000 سی سی و ... )
|
|
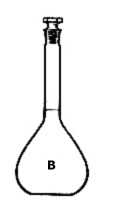
بالن حجم سنجی ( بالن ژوژه): از این بالن برای رقیق کردن محلولها و یا تهیه ی محلول های استاندارد استفاده میشود. برروی گردن باریک آن خط نشانه ی حلقوی وجود دارد که گنجایش حجمی را مشخص می کنند. با توجه به حجم آن، مشخص می گردد.

پی پت : برای برداشتن حجم معینی از مایعات به کار میرود ، صفر آن در بالاست. دارای دو نوع است : حباب دار و ساده. برای پر کردن آن بهتر است از پووار استفاده کرد.
|
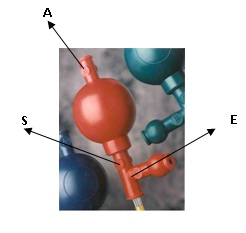
پی پت پمپ (پووار) : از پووار براي مكش استفاده مي شود اما در صورتيكه موادسمي باشند قبل از استفاده از پووار بايد از سالم بودن آن اطمينانحاصل كنيم و آنرا باآب امتحان كنيم.
طرز استفاده: دكمه A براي خالي كردن هواي داخل پووار است. دكمه S براي مكش مواد سمي است. دكمهE براي خالي كردن مواد مكش شده است.
استوانه ی مدرج : استوانه ای است که پایه دارد و بر خلاف بورت وپیپت درجه بندی آن از پایین آغاز میشود.از آن برای اندازه گیری حجم معینی از محلول ها استفاده میشود. برای تعیین حجم اجسام جامد بی شکل نیز کاربرد دارد.

گیلاس مدرج : از آن برای برداشتن حجم معینی از مایعات برای پر کردن بورت و استوانه مدرج استفاده میشود.

قطره چکان : برای برداشتن مقدار دقیق و کمی از مایعات و محلول ها مثل شناساگرها و همچنین برای برداشتن محلول هایی که بخار های سمی تولید میکنند و یا محلول هایی که هنگام ریختن ممکن است بر دست یا لباس بریزد استفاده میشود.

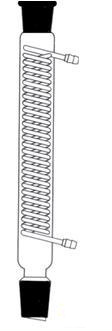
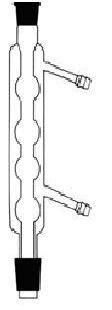
مبرد (سرد کننده) : برای سرد کردن بخار حاصل از تبخیر مایعات به کار می رود که برروی دستگاه تقطیر بسته میشود.
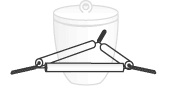
مثلث نسوز : مثلثی است فلزی که از سه قطعه روکش چینی نسوز ساخته شده است و از آن برای نگه داشتن بوته چینی در هنگام گرم کردن استفاده میشود.


ظرف پتری (پلیت) : برای نگه داری محلولها و نمونه های میکروبی به کار می رود.

|
میله و پایه : برای بالا نگه داشتن وسایل معمولا به همراه گیره به کار می رود.

گیره : از آن برای نگه داشتن بیشتر وسایل(مانند: ارلن، بالن و ... ) بر روی میله و پایه استفاده می گردد.

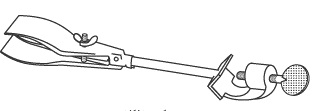
گیره ی بورت : از آن برای نگه داشتن بورت ، لوله آزمایش ، دماسنج و ... استفاده میشود.

سه پایه : برای قرار دادن ظرف های ته صاف (مانند: ارلن و بشر و...) به طور غیر مستقیم برروی آتش کاربرد دارد. باید روی آن توری نسوز یا مثلث نسوز قرار داد.
|
پنس : برای برداشتن و نگه داشتن مقدار کمی ماده ی جامد بر روی آتش و ... به کار می رود.

هود آزمایشگاهی : نوعی تهویه ی محفظه دار است. آزمایشهایی را که تولید گازهای سمی می کنند در آن انجام می دهند تا بخارهای سمی به وسیله ی تهویه ی آن، به هوای بیرون آزمایشگاه برود.
کوره : دستگاهی است که برای گرم کردن مواد به مدت طولانی به کار می رود.
درپوش : لاستیکی یا چوب پنبه ای است و برای بستن سر لوله ی آزمایش، ارلن مایر، بالن و ... به کار می رود.
لوله ی رابط : لوله ای شیشه ایست که با گرم کردن روی آتش می توان آن را خم کرد. برای وصل کردن ظرفها ( ارلن، بالن و ... ) به کار میرود.
کاغذ صافی : نوعی کاغذ به شکل دایره است که برای جداکردن مواد جامد از مخلوط ها (مثلا جداکردن نشاسته از آب) به کار می رود. برای استفاده از کاغذ صافی باید آن را در قیف قرار داد.
گیره ی مخصوص دماسنج : برای اتصال دماسنج به میله و پایه به کار میرود.
نکته ی 1 : روش درست خواندن سطح مایع در پیپت ، استوانه مدرج ، لوله آزمایش و ... :
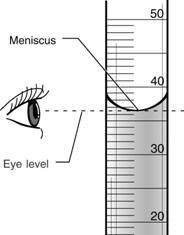
نکته ی 2 : واحد اندازه گیری حجم مواد مایع که بر روی وسایل آزمایشگاهی مانند پیپیت و بورت و بشر و ... نوشته شده است یکسان بوده و به صورت میلی لیتر یا سی سی یا سانتی مترمکعب خوانده می شود.
سایت رشته صنایع شیمیایی...برچسب : نویسنده : علیرضا فرزادنیا chemis بازدید : 356 تاريخ : شنبه 22 تير 1392 ساعت: 13:4 ت
آرشیو مطالب
- اسفند 1386
- مهر 1386
- آبان 1386
- دی 1387
- بهمن 1387
- اسفند 1387
- فروردين 1387
- خرداد 1387
- مهر 1387
- آبان 1387
- آذر 1387
- بهمن 1388
- اسفند 1388
- فروردين 1388
- ارديبهشت 1388
- خرداد 1388
- تير 1388
- شهريور 1388
- آبان 1388
- بهمن 1389
- اسفند 1389
- فروردين 1389
- ارديبهشت 1389
- خرداد 1389
- تير 1389
- شهريور 1389
- مهر 1389
- آبان 1389
- دی 1390
- بهمن 1390
- اسفند 1390
- فروردين 1390
- ارديبهشت 1390
- خرداد 1390
- مرداد 1390
- شهريور 1390
- مهر 1390
- آبان 1390
- آذر 1390
- دی 1391
- بهمن 1391
- اسفند 1391
- فروردين 1391
- ارديبهشت 1391
- تير 1391
- مرداد 1391
- شهريور 1391
- مهر 1391
- آبان 1391
- آذر 1391
- بهمن 1392
- اسفند 1392
- فروردين 1392
- تير 1392
- مرداد 1392
- شهريور 1392
- آبان 1392
لینک دوستان
- کرم سفید کننده وا
- دانلود آهنگ جدید
- خرید گوشی
- فرش کاشان
- بازار اجتماعی رایج
- خرید لایسنس نود 32
- هاست ایمیل
- خرید بانه
- خرید بک لینک
- کلاه کاسکت
- موزیک باران
- دانلود آهنگ جدید
- ازن ژنراتور
- نمایندگی شیائومی مشهد
- مشاوره حقوقی تلفنی با وکیل
- کرم سفید کننده واژن
- اگهی استخدام کارپ
- دانلود فیلم
- آرشیو مطالب
- فرش مسجد
- دعا
- لیزر موهای زائد
- رنگ مو
- شارژ


![[تصویر: 70513024520051311881122091881794184110173.gif]](http://img.tebyan.net/big/1389/05/70513024520051311881122091881794184110173.gif)